Las estatinas y el concepto de placa vulnerable
Desde que se demostrara que las estatinas eran capaces de reducir la incidencia de eventos cardiovasculares en el estudio 4S (Scandinavian Simvastatin Survival Study)1 este grupo de fármacos ha constituido una terapia clave contra la enfermedad cardiovascular.
Además, el estudio de las estatinas mejoró nuestros conocimientos sobre la patogenia de la aterosclerosis. En este sentido, los estudios angiográficos mostraban que la reducción en la progresión de la placa aterosclerótica que conseguían era muy leve para explicar la disminución de eventos cardiovasculares2. Por otra parte, los beneficios clínicos aparecían demasiado pronto como para que hubiera efectos significativos sobre la progresión de la placa3. Por tanto, debía de haber algo más que la simple inhibición del progreso de las lesiones ateroscleróticas como causa de los beneficios de las estatinas. Estas observaciones llevaron al concepto de vulnerabilidad de la lesión aterosclerótica. Este concepto implicaba que las lesiones no sólo progresan de forma lenta, sino que pueden complicarse bruscamente con la formación de un trombo, lo que puede dar lugar a un evento vascular agudo, como un infarto de miocardio o un ictus. Además, la posibilidad de que las placas se compliquen no es una función del grado de estenosis que produzcan, sino de otras características, entre las que se encuentran, por ejemplo, el grado de inflamación que tengan4. La inflamación implica alto contenido de macrófagos que liberan enzimas que debilitan la cápsula de las lesiones, favoreciendo su ruptura y trombosis. Múltiples investigaciones han mostrado que las estatinas actúan a diversos niveles, que favorecen la estabilidad de las lesiones, y se conocen comúnmente como efectos pleiotrópicos. Entre ellos están la mejoría de la función endotelial, la disminución de la proliferación celular, el efecto antiinflamatorio, y la acción antitrombótica5.
Figura 1. Vía del mevalonato. Comienza con acetil coenzima A (Acetil-CoA) y da lugar a colesterol. Sin embargo, hay compuestos intermedios como el farnesil-PP (pirofosfato) que son relevantes en la prenilación de proteínas necesarias para efectúen su función.
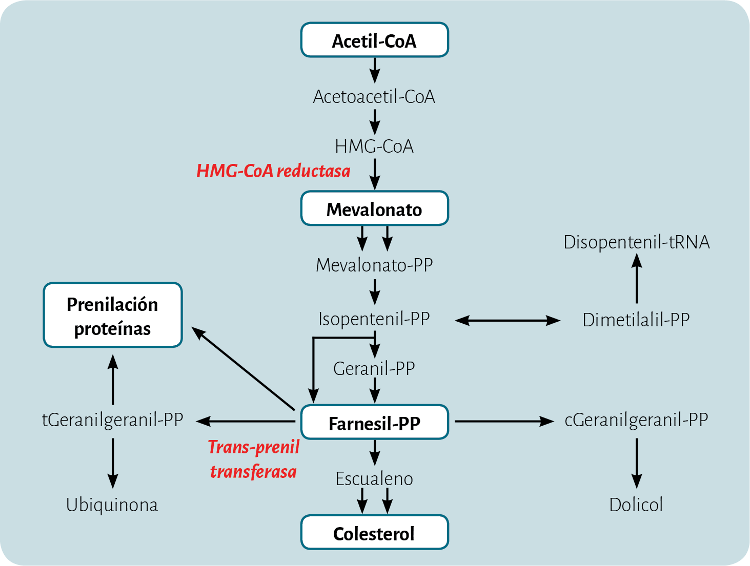
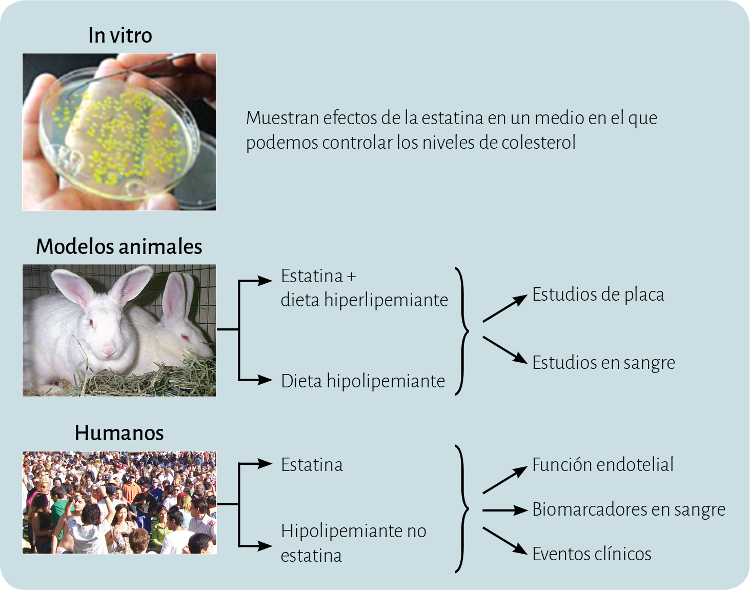
Figura 2. Aproximaciones experimentales a los efectos directos de las estatinas.
La teoría de los efectos de las estatinas independientes del colesterol
Surgió entonces la idea de que una parte de los efectos vasculoprotectores que producían podían ser mediados por mecanismos independientes de su efecto hipolipemiante. Esta idea se apoyaba en observaciones como la realizada con los pacientes del estudio WOSCOPS (West of Scotland Coronary Prevention Study) en prevención primaria, en el que se comparaba el uso de pravastatina con placebo6. En este estudio se observó que los pacientes asignados a pravastatina presentaban menos eventos coronarios que los tratados con placebo que tenían niveles similares de LDL (low-density lipoprotein)7. Este concepto era de potencial interés a muchos niveles. Por ejemplo, los beneficios clínicos de las estatinas no podrían ser extrapolados a otros fármacos hipolipemiantes. Toda esta información dio lugar a abundante literatura, en la que incluso se llegaron a apuntar efectos de las estatinas no limitados al ámbito cardiovascular.
Las estatinas reducen la síntesis de colesterol mediante el bloqueo del enzima hidroxi-metil-glutaril coenzima A reductasa (HMG-CoA reductasa), en el inicio de la denominada vía del mevalonato (figura 1). El resultado final es una disminución de la síntesis de colesterol intracelular, lo que llevará a un incremento en la expresión de receptores de LDL, que captarán esta lipoproteína hacia el interior de la célula, aclarándola de la sangre. Sin embargo, algunos compuestos intermedios de esta vía están implicados en modificaciones postraduccionales de proteínas clave8 implicadas en importantes funciones celulares. Así, el farnesil-PP (pirofosfato), a través del efecto de la trans-prenil transferasa da lugar al tgeranilgeranilPP, implicado en la prenilación de proteínas. Entre estas proteínas están las denominadas pequeñas proteínas G, como Ras, Rho y Ras-like8, que juegan un papel en los mecanismos de transducción de señales celulares. A la vista de este dato, se postuló que el bloqueo de estas vías de señalización en las células ateroscleróticas podría interferir con la aterogénesis independientemente de la inhibición de la síntesis de colesterol8.
Evidencias de los efectos de las estatinas independientes del colesterol
El primer nivel de evidencia procede de estudios in vitro (figura 2). En estos experimentos se pueden cultivar los diferentes tipos celulares que encontramos en las lesiones ateroscleróticas -como células endoteliales, monocitos y células musculares lisas vasculares- a las que se puede administrar una estatina sin que haya cambios de los niveles de colesterol del medio de cultivo. En estos trabajos se ha visto que las estatinas tienen efectos antiinflamatorios9, antitrombóticos y antiproliferativos in vitro en ausencia de cambios en las concentraciones lipídicas. Más aún, estos efectos se revierten al añadir mevalonato, pero no otros compuestos por debajo de farnesil-PP, pese a que restablecen la síntesis de colesterol.
El siguiente nivel procede del estudio de modelos animales. Una de las estrategias más comúnmente utilizadas en los modelos animales de aterosclerosis para estudiar los efectos directos de las estatinas consiste en observar sus acciones a nivel de la placa comparándolas con modificaciones dietéticas que inducían reducciones similares de colesterol. Con esta aproximación, Williams et al observaron que la pravastatina reducía el infiltrado de macrófagos en monos más que el grupo tratado con dieta10. De modo similar, nuestro grupo demostró que la simvastatina reducía más el infiltrado de macrófagos y la expresión de IL-8 en la pared vascular que una manipulación dietética que produjera incluso menores niveles de colesterol en un modelo de conejo11. Por otra parte, las estatinas también disminuyen la adhesión y transmigración de leucocitos y el contenido de colesterol en la aorta en diversos modelos animales en ausencia de cambios en los niveles lipídicos12-14. Otra estrategia es estudiar el beneficio de estos fármacos en patologías en las que el aumento del colesterol no parece jugar un papel, tales como esclerosis múltiple15 y la inflamación articular, entre otros16,17.
A la vista de estos datos, parece claro que los estudios in vitro y en animales muestran la existencia de acciones independientes del descenso de los niveles de colesterol. Sin embargo, los estudios in vitro no se realizan en condiciones fisiológicas, porque las células están aisladas del organismo. En cuanto a los estudios en animales, tampoco reproducen exactamente lo que ocurre en nuestro organismo, pues las lesiones ateroscleróticas se desarrollan artificialmente, de modo más rápido a como tienen lugar en el ser humano, ya que en investigación interesa tener resultados a corto plazo.
Dadas las limitaciones expuestas de los trabajos realizados a nivel básico, es esencial analizar si en seres humanos se confirma la hipótesis de los efectos de las estatinas independientes del colesterol. Sin embargo, en humanos los datos son menos claros. Por ejemplo, las estatinas disminuyen modestamente la inflamación en pacientes con artritis reumatoide18, un efecto que podría ser independiente de los lípidos. Sin embargo, se han logrado efectos similares con ezetimibe19, que reduce el LDL a través de un mecanismo diferente. Por otra parte, se demostró que las estatinas comparadas con ezetimibe tienen mayor efecto antiinflamatorio y mayor beneficio sobre la función endotelial20, pero estos resultados no se confirmaron en otros estudios21. Finalmente, un reciente metaanálisis demuestra que la reducción del riesgo cardiovascular obtenida con el descenso de LDL por otras terapias hipolipemiantes es similar al que se consigue en las estatinas22. Así, aunque la investigación básica demuestra que una parte de los efectos antiinflamatorios de las estatinas es independiente de los lípidos, esta hipótesis no se ha confirmado convincentemente en los seres humanos. Esta aparente discrepancia puede reflejar la biodistribución de las estatinas después de la toma oral, como lo demuestran los estudios que administran la formulación de nanopartículas de estatinas en modelos experimentales de aterosclerosis23. Así, las estatinas administradas ligadas a partículas de HDL (high-density lipoprotein) ejercen potentes efectos antiinflamatorios en las placas de ateroma23,24. En contraste, las dosis habituales apenas afectaron la inflamación de la placa, lo que ilustra que la depuración del primer paso de las estatinas por el hígado impide un claro efecto antiinflamatorio in vivo.
Conclusión
En conclusión, la hipótesis de que las estatinas pueden tener efectos independientes de la bajada de colesterol es una idea atractiva que ha encontrado soporte a nivel experimental, pero no en estudios clínicos. Por tanto, a la hora de pautar tratamiento hipolipemiante debemos tener claro que lo importante para reducir el riesgo cardiovascular es bajar el colesterol LDL. La ventaja de las estatinas sobre otros métodos no son los posibles efectos independientes del colesterol sino la extensa evidencia científica que las apoya y la larga trayectoria de estos fármacos en el mercado en los que han demostrado un excelente nivel de seguridad.
Referencias
- Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-9.
- Brown BG, Fuster V. Impact of management in stabilization of coronary disease in Atherosclerosis and coronary artery disease, edited by Fuster V, Ross R, Topol EJ, Philadelphia, Lippincott- Raven, 1996, pp 191-205.
- MIRACL Study Investigators. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes. JAMA 2001;285:1711-8.
- Mann JM, Davies MJ. Vulnerable plaque. Relation of characteristics to degree of stenosis in human coronary arteries. Circulation 1996;94:928-31.
- Corsini A, et al. News insights into the pharmacodynamic and pharmacokinetic properties of statins. Pharmacology and Therapeutics 1999;84:413-28.
- Shepherd J, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995;333:1301-7.
- West of Scotland Coronary Prevention study group: Influence of pravastatin and plasma lipids on clinical events in the West of Scotland Coronary Prevention Study (WOSCOPS). Circulation 1998;97:1440-5.
- Van Aelst L, D’Souza-Schorey Rho GTPases and signaling networks. Genes & Development 1997;11:2295-322.
- Hernández-Presa MA, et al. Atorvastatin reduces the expression of cyclooxygenase-2 in a rabbit model of atherosclerosis and in cultured vascular smooth muscle cells. Atherosclerosis 2002;160:49-58.
- Williams JK, et al. Pravastatin has cholesterol-lowering independent effects on the artery wall of atherosclerotic monkeys. J Am Coll Cardiol 1998;31:684-91.
- Hernández-Presa MA, et al. Simvastatin reduces NF- κB activity in peripheral mononuclear and in plaque cells of rabbit atheroma more markedly than lipid lowering diet. Cardiovasc Res 2003;57:168-77.
- Sparrow CP, et al. Simvastatin has antiinflammatory and antiatherosclerotic activities independent of plasma cholesterol lowering. Arterioscler Thromb Vasc Biol 2001;21:115-21.
- Prueffer D, et al. Simvastatin inhibits leukocyte-endothelial cell interactions and protects against inflammatory processes in normocholesterolemic rats. Arterioscler Thromb Vasc Biol 1999;19:2894-90014.
- Scalia R, et al. Simvastatin exerts both anti-inflammatory and cardioprotective effects in apolipoprotein E-deficient mice. Circulation 2001;103:2598-603.
- Youssef S, et al. The HMG-CoA reductase inhibitor, atorvastatin, promotes a Th2 bias and reverses paralysis in central nervous system autoimmune disease. Nature 2002;420:78-84.
- Leung BP, et al. A novel antiinflammatory role for simvastatin in inflammatory arthritis. Journal of Immunology (Baltimore, Md: 1950) 2003;170:1524-30.
- Sparrow CP, et al. Simvastatin Has Anti-Inflammatory and Antiatherosclerotic Activities Independent of Plasma Cholesterol Lowering. Arterioscler Thromb Vasc Biol 2001;21:115-21.
- McCarey DW, et al. Trial of Atorvastatin in Rheumatoid Arthritis (TARA): double-blind, randomised placebo-controlled trial. The Lancet 2004;363:2015-21.
- Mäki-Petäjä KM, et al. Ezetimibe and Simvastatin Reduce Inflammation, Disease Activity, and Aortic Stiffness and Improve Endothelial Function in Rheumatoid Arthritis. J Am Coll Cardiol 2007;50:852-8.
- Landmesser U, et al. Simvastatin versus ezetimibe: pleiotropic and lipid-lowering effects on endothelial function in humans. Circulation. 2005;111:2356-63.
- Grigore L, et al. Effect of treatment with pravastatin or ezetimibe on endothelial function in patients with moderate hypercholesterolemia. Eur J Clin Pharmacol 2013 Mar;69:341-6.
- Silverman MG, et al. Association between lowering ldl-c and cardiovascular risk reduction among different therapeutic interventions: A systematic review and meta-analysis. JAMA 2016;316:1289-97.
- Duivenvoorden R, et al. A Statin- Loaded Reconstituted High-Density Lipoprotein Nanoparticle Inhibits Atherosclerotic Plaque Inflammation. Nature Commun 2014;5:3065-3065.
- Tang J, et al. Inhibiting macrophage proliferation suppresses atherosclerotic plaque inflammation. Science Advances 2015;1:e1400223. PMID: 26295063.





