El perfil clínico del paciente con insuficiencia cardiaca (IC) que ingresa en el hospital o es remitido a nuestra consulta está sufriendo un cambio importante. La mayoría de nuestros pacientes son ahora de edad avanzada y manifiestan signos y síntomas de IC dentro de lo que podríamos llamar un “paciente complejo”. La complejidad de este paciente viene explicada en la mayoría de casos por presentar numerosas comorbilidades que dificultan su manejo clínico y agravan su pronóstico.
El cardiólogo tiene que adaptarse a este nuevo escenario y para ello es fundamental que adquiera conocimientos y habilidades que le permitan manejar estas comorbilidades. Una de las principales comorbilidades es el déficit de hierro, del que en los últimos años hemos aprendido que está presente en un elevado porcentaje de pacientes y su corrección redunda en un beneficio clínico. En las guías de la ESC del 2012 aparece recogido por primera vez, recomendando (1C) su detección dentro del manejo habitual de los pacientes con IC crónica. En este artículo abordaremos su fisiopatología y epidemiología, para sentar las bases que permitan posteriormente abordar la importancia de su detección, diagnóstico y tratamiento.
Metabolismo del hierro
El hierro es un oligoelemento presente en un gran número de sistemas moleculares e importante cofactor de una gran variedad de sistemas celulares, además de tener un papel importante en el transporte de oxígeno y en el crecimiento y proliferación celular. Su déficit se puede encontrar en la población general, especialmente en situaciones de perdida hemática (menstruación) o en estados de altos requerimientos como en la adolescencia y en el embarazo. La absorción se realiza a través de la pared del intestino y sólo es posible en la forma ferrosa o Fe (II), por lo que el hierro férrico o Fe (III) que se encuentra en muchos alimentos necesita ser reducido a Fe (II) antes de la absorción. Su absorción y distribución están estrictamente regulados y entre otros participan:
- La transferrina es responsable de transportar casi la totalidad del hierro circulante, así como de aportarlo a células y tejidos del cuerpo.
- El receptor de transferrina es el responsable de internalizar el hierro en la célula.
- La ferritina es una proteína del citosol celular en la que se acumu lan la mayoría de los depósitos de hierro. Esta protege las células de la toxicidad del hierro y evita que este reaccione con otros constituyentes celulares; además, permite su liberación controlada según los requisitos del organismo.
- La hepcidina es sintetizada en el hígado y participa en la autorregulación del hierro inhibiendo su absorción intestinal.
El hierro en su mayoría es destinado a la hematopoyesis, pero también un gran número de proteínas celulares necesitan hierro como un cofactor, participando de forma importante en la producción de ATP celular y en la cadena respiratoria mitocondrial. A pesar de que se ha aprendido mucho en los últimos años, aún no se tiene un conocimiento completo del tráfico del hierro celular. Los mecanismos de autorregulación son complejos, se retroalimentan y su regulación es múltiple. De forma simplificada, la Figura 1 refleja la distribución del hierro en el organismo en condiciones fisiológicas.
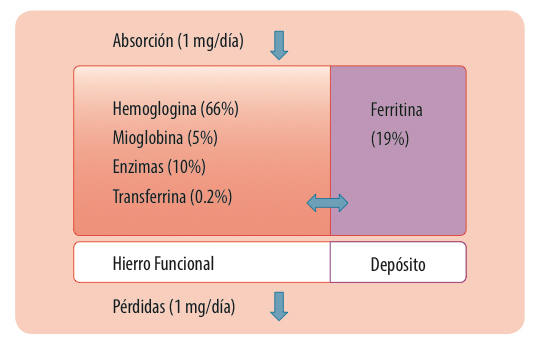
Figura 1. Distribución del hierro corporal en condiciones fisiológicas.
Causas de déficit de hierro en la IC
Desde un punto de vista práctico, es importante entender que el déficit de hierro puede ser clasificado como absoluto o funcional. Los pacientes con IC crónica pueden desarrollar un déficit de hierro por el desmantelamiento gradual de sus reservas de hierro (absoluto) o por disminución de la capacidad de movilizar el hierro desde el sistema reticuloendotelial en el que se encuentra almacenado (funcional). El déficit de hierro absoluto implica los depósitos de hierro agotados; el déficit de hierro funcional significa que el hierro está presente en el cuerpo humano, pero no puede ser movilizado para cumplir sus funciones. En la IC crónica el déficit de hierro se produce por múltiples mecanismos, tal como se muestra en la Figura 1, pero hay que destacar que la inflamación juega un papel fundamental, especialmente en el déficit funcional1, 2.
Consecuencias del déficit de hierro en la IC
El déficit de hierro provoca no solo anemia y sus consecuencias bien conocidas, sino que tiene su repercusión sobre sistemas celulares y tisulares, y finalmente sobre los pacientes (Figura 3). La ausencia de hierro en la sangre de los pacientes con IC puede ser también observada como una reducción de la carga de hierro en la médula ósea y en el miocardio3, 4. Su déficit afecta a los dos elementos principales que requieren hierro, los grupos hemo y Fe-S. La falta de grupos Fe-S a nivel celular redunda en una reducción de la producción de ATP durante el ciclo de citrato y, por tanto, da lugar a una reducción de la capacidad de ejercicio y a la fatiga, a la vez que puede ocasionar daño mitocondrial. El hierro es un constituyente esencial de la mioglobina, que se encuentra en el citoplasma y se une con avidez para liberar oxígeno. La función mitocondrial necesita hierro ya que el hierro es un cofactor para proteínas hemo que están involucradas en la transferencia de electrones y la producción de energía en las células. Esto explicaría que el déficit de hierro se relacione con la intolerancia al ejercicio de forma independiente respecto a los niveles de hemoglobina o la presencia de anemia5. El hierro es especialmente necesario en células con alta demanda energética por lo que, más allá de ocasionar anemia, este tiene un papel en la función del músculo esquelético y cardiaco6.

Figura 3. Consecuencias del déficit de hierro a nivel celular, tisular y poblacional.
Epidemiología
Los valores de referencia para establecer la presencia de déficit de hierro son diferentes en sujetos sanos y en pacientes con enfermedades crónicas como la IC. Los laboratorios suelen mostrar valores de corte de ferritina que reflejan el déficit absoluto de hierro en individuos sanos, en el orden de 20 a 30 mg/L. Sin embargo, el déficit absoluto de hierro en pacientes con IC puede estar presente una vez que la ferritina sérica es <100 mg/L, aunque el hierro sea normal, y el déficit funcional de hierro puede estar presente cuando la ferritina sérica es <300 mg/L con tasas de saturación de transferrina (TSAT) <20%.
De acuerdo a esta definición, Jankowska et al (2010) encontraron una tasa de déficit de hierro del 37±4% (57±10% en anémicos y 32±4% en no anémicos) en un estudio en 543 pacientes con IC crónica estable y disfunción sistólica7. Los factores de riesgo fueron el sexo femenino, un estadio más avanzado de la enfermedad, un valor más alto de NT-proBNP y de proteína C reactiva. Con la misma definición, Parikh et al (2011) encontraron una tasa del 61% de deficit de hierro en 574 pacientes del registro NHANES III que reportaron padecer IC8. Okonko et al (2011) usaron una definición basada sólo en una TSAT<20%, y encontraron, en 157 pacientes con IC crónica, una tasa de 43%9. En este estudio también correlacionó con una peor clase funcional NYHA y mayor proteína C reactiva.
Recientemente, Klip et al (2013) en un registro multinacional con 753 pacientes, usando la definición basada en ferritina y TSAT, han confirmado que alrededor de la mitad de todos los pacientes con IC o bien tienen ferropenia absoluta o bien déficit de hierro funcional10. Este hallazgo está sólo en parte asociado con la presencia de anemia y, de hecho, un 46% de pacientes sin anemia presentaban déficit de hierro en ausencia de anemia, como muestra la Figura 4.

Figura 4. Prevalencia de déficit de hierro en pacientes con IC, con y sin anemia (ref 10).
En estos estudios, de forma constante, la prevalencia del déficit de hierro fue mayor en relación con la clase funcional NYHA y el NT-pro- BNP, reflejando que la severidad y la progresión del cuadro clínico de IC son los factores de riesgo más importantes para su aparición11. Por otro lado, en estos estudios el déficit de hierro se asoció, de forma independiente respecto a la hemoglobina y/o anemia, así como respecto a otros factores, con una mayor mortalidad en el seguimiento7, 9, 10. Estos hallazgos epidemiológicos junto a las bases fisiopatológicas sugieren que la aparición de déficit de hierro en el curso de la enfermedad tenga un papel fisiopatológico causal en la progresión de la IC crónica (Figura 2).

Figura 2. Mecanismos implicados en el déficit de hierro, funcional o absoluto, en la IC.
Conclusiones
El déficit de hierro, absoluto o funcional, aparece de forma frecuente durante la progresión de la IC crónica, afectando a la mitad de nuestros pacientes. Además de ser causa de anemia, independientemente de ésta, la falta de hierro per se conlleva un deterioro en diferentes sistemas celulares y tisulares que redundan en una peor capacidad funcional y un mayor riesgo de muerte. Todo ello sugiere una participación directa del hierro en la fisiopatología de la enfermedad.
Referencias
- Fairbanks V, Beutler E. Iron deficiency. In Beutler E, editor. Williams Hematology. 6th ed. New York: McGraw-Hill 2001.
- Balla J, Jeney V, Varga Z, et al. Iron homeastasis in chronic inflammation. Acta Physiol Hung 2007;94:95-106.
- Jankowska EA, Ponikowski P. Molecular changes in myocardium in the course of anemia or iron deficiency. Heart Fail Clin 2010;6:295-304.
- Leszek P, Sochanowicz B, Szperl M, et al. Myocardial iron homeostasis in advanced chronic heart failure patients. Int J Cardiol 2012;159:47-52.
- Jankowska EA, Rozentryt P, Witkowska A, et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail 2011;17:899-906.
- Ebner N, von HS. Iron deficiency in heart failure: a practical guide. Nutrients 2013;5:3730-9.
- Jankowska EA, Rozentryt P, Witkowska A, et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J 2010;31:1872-80.
- Parikh A, Natarajan S, Lipsitz SR, Katz SD. Iron deficiency in community-dwelling US adults with self-reported heart failure in the National Health and Nutrition Examination Survey III: prevalence and associations with anemia and inflammation. Circ Heart Fail 2011;4:599-606.
- Okonko DO, Mandal AK, Missouris CG, Poole-Wilson PA. Disordered iron homeostasis in chronic heart failure: prevalence, predictors, and relation to anemia, exercise capacity, and survival. J Am Coll Cardiol 2011;58:1241-51.
- Klip IT, Comin-Colet J, Voors AA, et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013;165:575-82.
- Jankowska EA, Malyszko J, Ardehali H, et al. Iron status in patients with chronic heart failure. Eur Heart J 2013;34:827-34.
Sobre el autor
 Dr. Domingo Pascual Figal
Dr. Domingo Pascual Figal
Médico adjunto del Servicio de Cardiología. Hospital Universitario Virgen de la Arrixaca (Murcia)
























































![La SEC te lleva a AHA24 [IN] ∙ Estudio SUMMIT](images/telleva/acc24/1.%20SUMMIT.png#joomlaImage://local-images/telleva/acc24/1. SUMMIT.png?width=600&height=336)
![La SEC te lleva a AHA24 [IN] ∙ Estudio BROOKLYN](images/filtros/cardiotv/25.%20BROOKLYN.jpg#joomlaImage://local-images/filtros/cardiotv/25. BROOKLYN.jpg?width=600&height=336)

![La SEC te lleva a AHA24 [IN] ∙ Estudio REALIZE-K](images/filtros/cardiotv/18.%20REALIZE-K.jpg#joomlaImage://local-images/filtros/cardiotv/18. REALIZE-K.jpg?width=600&height=336)
![La SEC te lleva a AHA24 [IN] ∙ Estudio SARAH](images/filtros/cardiotv/20.%20SARAH.jpg#joomlaImage://local-images/filtros/cardiotv/20. SARAH.jpg?width=600&height=336)
![La SEC te lleva a AHA24 [IN] ∙ Estudio CLEAR SYNERGY (OASIS9)](images/filtros/cardiotv/14.%20CLEAR%20OASIS9.jpg#joomlaImage://local-images/filtros/cardiotv/14. CLEAR OASIS9.jpg?width=598&height=336)















.png)


